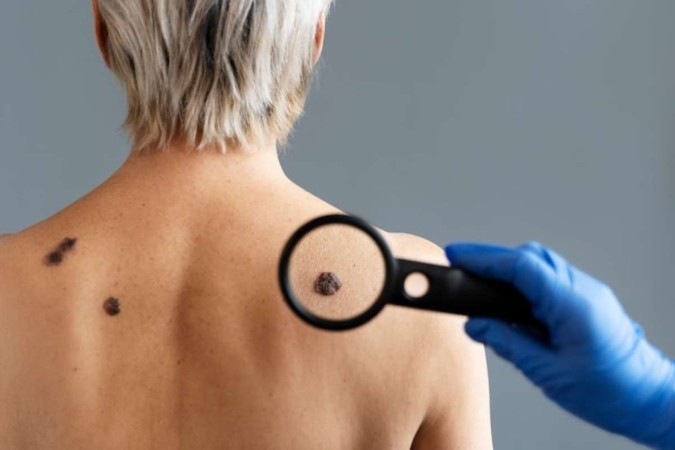
A utilização de uma nova imunoterapia baseada na aplicação de linfócitos infiltrantes de tumor (TILs) para tratar o melanoma (câncer de pele que começa nas células produtoras de pigmento da pele) apresentou eficácia bastante elevada. Estudo com 73 pacientes registrou 31,5% de regressão da doença. A nova técnica foi autorizada pela Food and Drug Administration (FDA), a agência de vigilância sanitária norte-americana.
-
Posição ao dormir interfere na saúde do cérebro; saiba qual a melhor
-
Arqueólogo encontra local de batalha bíblica entre anjo e 185 mil soldados
Por esse novo método de imunoterapia, denominado lifileucel, há transferência celular adotiva (ACT), utilizando os linfócitos infiltrantes de tumor (TILs) do paciente, que são isolados de uma célula doente em crescimento e ressecada. O procedimento é realizado em laboratório, usando interleucina-2 (IL-2), um fator de crescimento de células T, são reinfundidos, no mesmo paciente, cujo alvo são as células tumorais.
Esses TILs representam um "fármaco vivo" capaz de proliferar milhares de vezes à medida que circulam no paciente portador de câncer. A técnica é prevista para pacientes adultos com melanoma avançado, resistente a outros tratamentos eficazes.
A capacidade do ACT usando TILs de obter a regressão do câncer foi relatada, pela primeira vez, em camundongos em 1986 e, em humanos em 1988. Para os cientistas, esse intervalo de tempo foi importante para o aperfeiçoamento de estudos e avanços tecnológicos.
Nos camundongos, com diagnóstico de melanoma, a administração de IL-2 após a infusão de células T ajudou a promover a sobrevivência e o crescimento in vitro das células transferidas e, portanto, a administração de IL-2 foi adicionada ao regime de tratamento. Nas décadas seguintes à descrição da ACT usando TILs, vários estudos relataram respostas clínicas positivas usando TILs em pacientes com melanoma refratário.
Foram realizados testes em 192 pacientes, diagnosticados com melanoma metastático, que receberam TILs, no Surgery Branch do National Cancer Institute. Todos foram tratados apenas com uma dose do inibidor imunológico antiproteína programada 1 (PD1) e apresentaram reações positivas. Em 56% dos casos, houve regressão da doença. Já em 25%, a regressão foi completa. Após 7 anos de acompanhamento, verificou-se que de 48 pacientes, 46 já não estavam mais doentes. Somente dois pacientes registraram a reincidência do câncer.
Preparação
Linfócitos infiltrantes de tumor (TILs) são cultivados in vitro na presença de interleucina-2 (IL-2) de múltiplos fragmentos do tumor ressecado. O sequenciamento de exoma completo e RNA do tumor e tecido normal pode identificar todas as mutações de câncer codificadas que são apresentadas nas células dendríticas do paciente.
Os linfócitos extravasam, após 10 a 14 dias, antes de serem estimulados com um anticorpo monoclonal anti-CD3, um fator de crescimento não específico que é apresentado por um excesso de linfócitos periféricos normais irradiados, para permitir a proliferação adicional dos TILs por mais 10 a 14 dias antes de serem colhidos para infusão. Assim, são necessários de 20 a 28 dias para produzir os TILs, que representam um medicamento distinto que é adequado apenas para o paciente individual.
Para os cientistas, o maior desafio com a imunoterapia ACT, usando TILs, é o desenvolvimento de terapias eficazes para pacientes com cânceres epiteliais sólidos e com metastáse, que não podem ser curados por tratamentos disponíveis, responsáveis por 90% das mortes.
Até o momento, esses tumores apresentaram resistência à nova terapia. Pesquisas recentes mostram que mais de 70% de todos os tipos de câncer epitelial são reativos, apresentando proteínas derivadas de mutações, não obtendo efeito positivo à nova terapia.
Câncer de pele
O melanoma é um dos raros cânceres que demonstram responder de forma positiva à terapia TIL não selecionada, provavelmente em parte devido à frequência aumentada de mutações potencialmente imunogênicas em comparação com sua frequência em cânceres epiteliais sólidos.
Reprogramação genética
Pesquisadores da Penn State, nos Estados Unidos, criaram um método que busca inocular as células cancerígenas sem atingir as saudáveis, por meio da reengenharia genética. A base de inspiração é a reprogramação computacional utilizada para combater os vírus mais insistentes, que atingem o sistema de informática. É como se fosse um jogo em que o desafio é eliminar apenas os pontos doentes. A ideia é "reprogramar" o sistema orgânico, monitorando a evolução da doença, para direcionar o tratamento para os tumores mais resistentes.
O circuito genético modular transforma células cancerígenas em um "Cavalo de Troia", mesmo nome do vírus que afeta o sistema de informática, fazendo com que elas se autodestruam e destruam a células cancerígenas resistentes a medicamentos. O método foi testado em camundongos, observando a reação ao tratamento para o câncer de pulmão. A pesquisa foi publicada na Nature Biotechnology.
"Essa ideia nasceu da frustração", admitiu Dorothy Foehr Huck e J. Lloyd Huck, professora associada de Engenharia Biomédica Empreendedora e autora sênior do artigo. Segundo ela, é fundamental buscar meios para tratar o câncer, sobretudo quando a doença está bastante avançada. Para Justin Pritchard, pesquisador que atuou no estudo, os genes de seleção "são um novo paradigma poderoso para a terapia anticâncer guiada pela evolução".
Heterogeneidade
Os cientistas ressaltam que, muitos medicamentos contra o câncer não surtem os efeitos desejados porque são imensas a diversidade e a heterogeneidade de tumores. Pritchard lembrou que, por vezes, o ciclo de tratamento aumenta a tal ponto de extinguir todas as alternativas.
"Você está jogando um jogo de Whac-A-Mole", afirmou Scott Leighow, pós-doutor em engenharia biomédica e autor principal do estudo, referindo-se ao jogo infantil repleto de luzes e recursos cujo desafio é mirar com um bastão os pontos certos. "Você não sabe o (ponto) que vai aparecer, então você não sabe qual será o melhor medicamento para tratar o tumor. Estamos sempre na defensiva, despreparados."
A equipe criou um circuito modular, ou unidade de seleção de gene dual-switch, para introduzir em células de câncer de pulmão não pequenas uma mutação do gene EGFR. Essa mutação é um biomarcador que os medicamentos existentes no mercado podem atingir.
O circuito tem dois genes ou interruptores. O interruptor 1 é o que age como um gene de seleção, permitindo que os pesquisadores liguem e desliguem a resistência a medicamentos, como um interruptor de luz. Com o interruptor um ligado, as células geneticamente modificadas tornam-se temporariamente resistentes a um medicamento específico. No caso testado foi um medicamento pequeno para câncer de pulmão.
Quando o tumor é tratado com o medicamento, as células cancerígenas sensíveis são destruídas, deixando para trás as que foram modificadas, formando uma pequena "população" resistente. As células modificadas eventualmente crescem e expulsam as células resistentes nativas, impedindo que multipliquem e desenvolvam nova resistência.
O tumor resultante contém predominantemente células geneticamente modificadas. Quando o interruptor 1 é desligado, as células se tornam sensíveis aos medicamentos novamente. O interruptor 2 é a carga terapêutica — e contém um gene suicida que permite que as células modificadas fabriquem uma toxina difusível que é capaz de matar células modificadas e vizinhas não modificadas.
Perspectivas
"(O gene suicida) não só mata as células projetadas, mas também elimina aquelas ao redor, ou seja, a população nativa resistente", disse Pritchard. "Isso é crítico. Essa é a população da qual você quer se livrar para que o tumor não volte a desenvolver."
A equipe primeiro simulou as populações de células tumorais e usou modelos matemáticos para testar o conceito. Em seguida, os cientistas clonaram cada switch, separando-os em vetores virais e testando sua funcionalidade individualmente em linhas de células cancerígenas humanas. Os cientistas acoplaram os dois switches em um único circuito e testaram novamente. Quando o circuito provou funcionar in vitro, a equipe repetiu os experimentos em camundongos.
Para a equipe, era importante ir além de saber como o circuito funcionava, mas verificar quando seria ativado. Foi testado o sistema usando variantes genéticas complexas de resistência para ver se o gene drive poderia funcionar para combater todas as formas genéticas pelas quais a resistência poderia ocorrer nas populações de células cancerígenas.
Com algumas células modificadas, pode assumir o controle da população de células cancerígenas e erradicar altos níveis de heterogeneidade genética. "O melhor é que conseguimos atingir as células cancerígenas sem saber o que elas são, sem esperar que elas cresçam ou que surja resistência porque aí já é tarde demais", ressaltou Leighow. O próximo desafio é interpretar esse circuito genético para administrá-lo com segurança e seletividade em tumores em evolução e estágios da doença com metástase.
Saiba Mais
Gostou da matéria? Escolha como acompanhar as principais notícias do Correio:
Dê a sua opinião! O Correio tem um espaço na edição impressa para publicar a opinião dos leitores pelo e-mail sredat.df@dabr.com.br
 Esportes
Esportes
 Brasil
Brasil
 Esportes
Esportes
