
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, ontem, o registro de um produto que utiliza as próprias células T do paciente para o combate ao câncer hematológico — originário das células sanguíneas. Classificado como um produto de terapia avançada, o Kymriah (tisagenlecleucel), desenvolvido pela farmacêutica suíça Novartis, faz parte de uma nova geração de imunoterapias contra a doença.
No tratamento, as células T do paciente são coletadas e enviadas para um centro médico, nos Estados Unidos, onde são geneticamente modificadas. Nessa alteração, inclui-se novos genes, que contêm uma proteína específica capaz de direcionar as células T para atacar as partículas cancerígenas.
"Depois de modificadas no laboratório, as células são cultivadas e formuladas em suspensão farmacêutica para compor o produto que será inoculado no paciente", esclareceu a Anvisa.
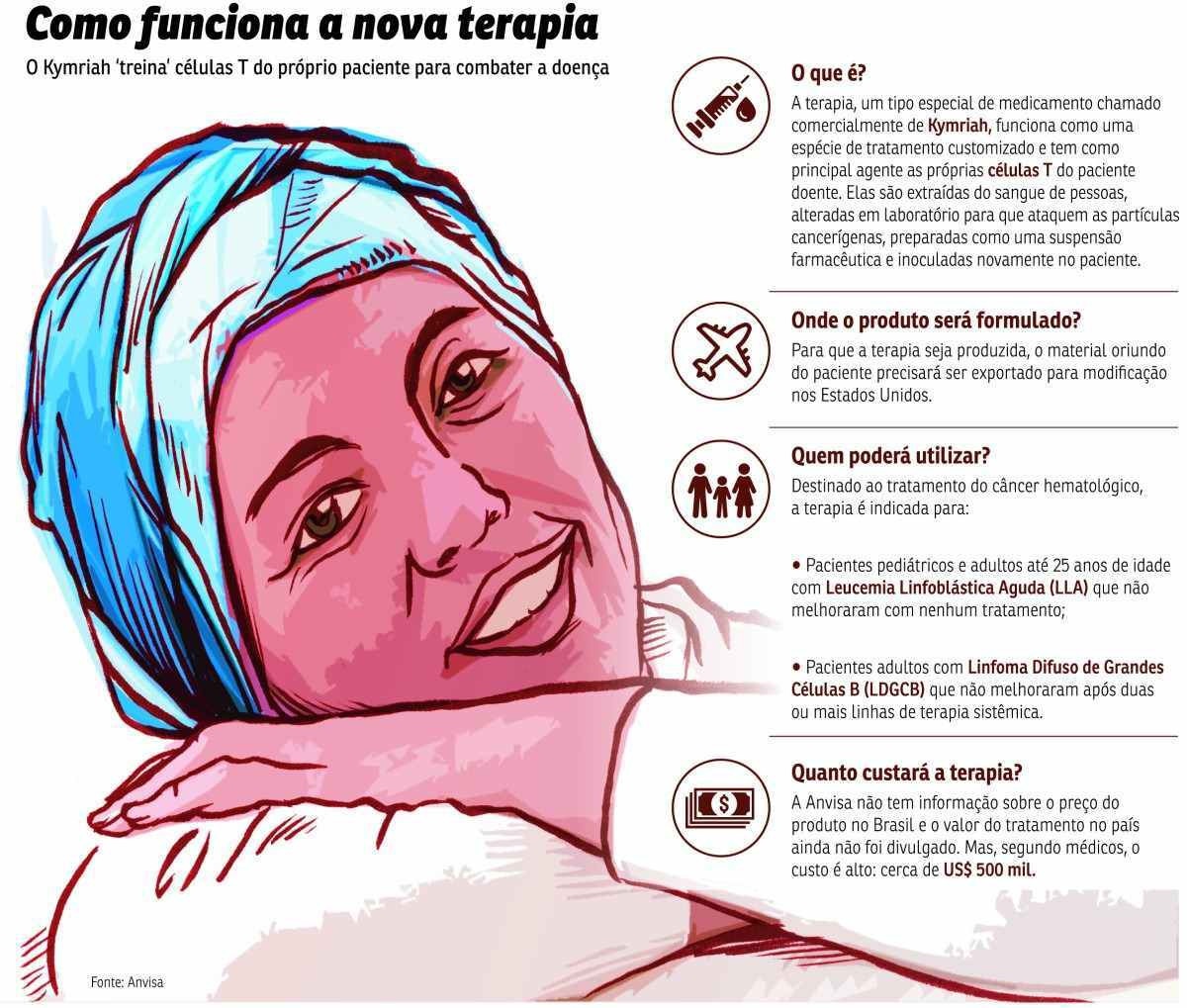
É a primeira vez que a Anvisa registra um produto que utiliza o material do próprio paciente para o tratamento do câncer. No Brasil já existem outras duas terapias avançadas aprovadas pela Anvisa, mas destinadas ao combate da atrofia muscular espinhal e das distrofias retinianas.
O Kymriah se aplica aos pacientes pediátricos e aos adultos com até 25 anos de idade que sofrem de leucemia linfoblástica aguda (LLA) de células B, mas que não melhoraram com nenhum tratamento. O produto serve, também, para os pacientes adultos com linfoma difuso de grandes celulas B (LDGCB), que não apresentaram melhoras depois de duas ou mais linhas de terapia sistêmica.
Saiba Mais
-
![]() Brasil
Expo Dubai traz tecnologia de ponta para mobilidade urbana e aérea
Brasil
Expo Dubai traz tecnologia de ponta para mobilidade urbana e aérea
-
![]() Brasil
Mortos pelas chuvas em Petrópolis chegam a 204, segundo o Corpo de Bombeiros
Brasil
Mortos pelas chuvas em Petrópolis chegam a 204, segundo o Corpo de Bombeiros
-
![]() Brasil
Forças de segurança dão ultimato a Zema e querem 'solução' até sexta (25)
Brasil
Forças de segurança dão ultimato a Zema e querem 'solução' até sexta (25)
-
![]() Brasil
Confira os resultados da Lotofácil 2456 e da Lotomania 2279 desta quarta-feira (23/2)
Brasil
Confira os resultados da Lotofácil 2456 e da Lotomania 2279 desta quarta-feira (23/2)
Nova opção
Segundo a Anvisa, o Kymriah é uma alternativa de tratamento que atende à necessidade de pacientes com câncer grave. "É uma nova opção onde as alternativas são muito limitadas, com taxas de remissão e sobrevivência promissoras nos ensaios clínicos avaliados pela Anvisa", observou a agência. Um dos ensaios com o fármaco, apresentado na revista especializada Nature, indicou a remissão do câncer por mais de uma década em dois homens submetidos ao tratamento.
A terapia com o Kymriah foi aprovada por outras agências reguladoras, como a dos Estados Unidos, do Japão e da Europa. Na Anvisa, a análise durou 268 dias.
Paralelamente à aprovação da agência, estabeleceram-se medidas de responsabilização e controle da terapia. Entre elas, o treinamento dos profissionais de saúde envolvidos no manejo do produto e a qualificação específica para os serviços de saúde nos quais esses especialistas trabalharão.
Além disso, como gestão de risco, uma medida acertada com a Novartis foi a realização de um estudo pós-registro da terapia. A ideia é observar os pacientes tratados com o produto e monitorar a segurança e a eficácia do tratamento a longo prazo.
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil