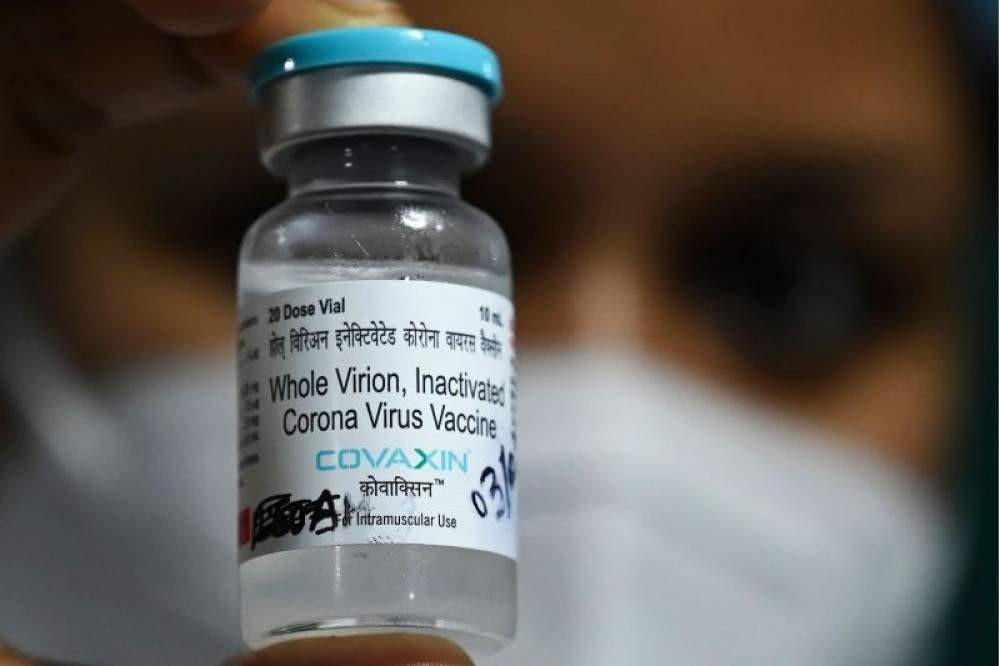
A Agência Nacional de Vigilância Sanitária (Anvisa) negou, nesta terça-feira (30/3), a certificação de boas práticas de fabricação à Bharat Biotech International, empresa que produz a vacina indiana Covaxin. O documento, negado à fabricante do imunizante, garante que a empresa cumpre com práticas necessárias para assegurar a qualidade, eficácia e segurança dos medicamentos e vacinas produzidos; e é necessário para a obtenção do registro de remédios e imunizantes no Brasil.
A falta da certificação, no entanto, não impede que a Covaxin consiga obter a autorização do uso emergencial ou de importação excepcional. “Importante ressaltar que o processo de CBPF é independente de outros processos, a exemplo do pedido de uso emergencial da vacina, assim como do pedido de importação excepcional”, disse a nota oficial da agência.
Apesar disso, o cronograma da entrega de vacinas previsto pelo Ministério da Saúde pode ser afetado. A pasta assinou o contrato de R$ 1,614 bilhão para a compra de 20 milhões de doses do imunizante indiano e pediu à Anvisa na última semana autorização para importar as doses da Covaxin.
A inspeção nas instalações da fábrica da Bharat Biotech, localizada na Índia, foi realizada entre 1º e 5 de março. Após a verificação, a Gerência Geral de Inspeção e Fiscalização Sanitária da Anvisa concluiu “que o plano de ação enviado pela empresa não é suficiente para mitigar todos os riscos envolvidos na fabricação da vacina em curto prazo”.
Segundo nota oficial do órgão regulador, durante a visita à fábrica foram constatados diferentes pontos que trazem “risco significativo à fabricação e à garantia de qualidade do produto”, que implicam em “risco sanitário aos usuários”.
Entre os pontos identificados na inspeção apontados pela Anvisa estão problemas com a potência da vacina, com a inativação viral e até mesmo com a pureza do imunizante.
Problemas identificados
Quanto à potência da vacina, a agência brasileira diz que a empresa não utiliza um método de controle específico para quantificar o conteúdo antigênico, responsável por formar os anticorpos, nesse caso contra a covid-19, no corpo humano. “A vacina pode apresentar variações de conteúdo antigênico e consequentemente comprometer a sua eficácia”, diz a análise da Anvisa.
Em relação à inativação viral, a preocupação da Anvisa é com a segurança do produto. Por a Covaxin ser um imunizante de vírus inativado, a empresa precisa garantir que o vírus foi completamente inativado durante a fabricação da vacina. Segundo a Anvisa, contudo, a fábrica não validou o método de análise que comprova a completa inativação do vírus.
Além disso, o órgão regulador afirmou que a Bharat Biotech não adota todas as precauções necessárias para garantir a esterilidade do produto e não possui uma estratégia de controle adequada para garantir a pureza da vacina.
Adequação
Ainda em nota oficial, a Anvisa indicou que o plano de ação apresentado pela Precisa Medicamentos, empresa brasileira responsável pela importação da Covaxin, reconhece as observações feitas pela equipe inspetora e “se propõe a adequar todas as não conformidades até 30 de julho”.
Com a certificação de boas práticas negada neste primeiro momento, a empresa poderá finalizar processos propostos no plano de ação para depois requisitar uma nova aprovação.
Saiba Mais
-
![]() Brasil
Covid-19: novo cronograma de vacinas prevê 10 milhões de doses a menos
Brasil
Covid-19: novo cronograma de vacinas prevê 10 milhões de doses a menos
-
![]() Brasil
Anvisa recebe pedido de importação da Covaxin, mas diz que faltam documentos
Brasil
Anvisa recebe pedido de importação da Covaxin, mas diz que faltam documentos
-
![]() Brasil
MS pede à Anvisa liberação de 20 milhões de doses da Covaxin
Brasil
MS pede à Anvisa liberação de 20 milhões de doses da Covaxin
-
![]() Brasil
Butanvac: vacina é ótima notícia, mas prazo anunciado é difícil de cumprir, dizem cientistas
Brasil
Butanvac: vacina é ótima notícia, mas prazo anunciado é difícil de cumprir, dizem cientistas
Notícias pelo celular
Receba direto no celular as notícias mais recentes publicadas pelo Correio Braziliense. É de graça. Clique aqui e participe da comunidade do Correio, uma das inovações lançadas pelo WhatsApp.
Dê a sua opinião
O Correio tem um espaço na edição impressa para publicar a opinião dos leitores. As mensagens devem ter, no máximo, 10 linhas e incluir nome, endereço e telefone para o e-mail sredat.df@dabr.com.br.
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil
 Brasil
Brasil